Executando os cálculos encontramos o valor da entalpia da formação do HBr como sendo -51 Kj/mol. Alternativa d)
Dados
H-Br= +361 Kj/mol
H-H= +436 Kj/mol
Br-Br= 184 Kj/mol
Reação que ocorre
½ H₂ + ½ Br₂ → HBr
- temos
- nos reagentes:
0,5 ligações H-H (H₂)
0,5 ligações Br-Br (Br₂)
- no produto
1 ligação H-Br (HBr)
assim:
[tex]\Delta~H=[0,5\times(H-H)+0,5(Br-Br)-(H-Br)]\\ \\ \Delta~H=[0,5\times436~Kj+0,5\times184~Kj]-361~Kj\\ \\ Delta~H=218+92-361\\ \\ Delta~H=-51~Kj[/tex]
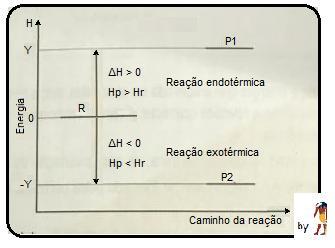
- uma reação ocorre quando as ligações dos reagentes são rompidas e, para isto, absorvem energia;
- ao se formar novas ligações nos produtos (novas substâncias) ocorre liberação de energia.
- reagentes: absorvem energia ao se romper sinal positivo.
- produtos: liberam energia ao se formar, sinal negativo;
- a variação de energia (ΔH) é a soma das energias absorvidas pelos reagentes menos a soma das energia liberadas pelos produtos.
Veja mais em: https://brainly.com.br/tarefa/28917924
https://brainly.com.br/tarefa/29648073