(USF-SP) O sistema gasoso a seguir representa um importante equilíbrio químico existente na atmosfera terrestre, especialmente em regiões bastante poluídas com emissão do dióxido de enxofre que é derivado da combustão de determinados combustíveis.(foto)Para esse equilíbrio químico, determinea) a expressão que representa a constante de equilíbrio para esse sistema, em função de suas concentrações molares.b) o valor da constante de equilíbrio sabendo aue a reação iniciou com 50g de SO² (o dois é embaixo), e com quantidade suficiente de O² em um recipiente de 2,0 L e atingiu o equilíbrio após 40% de transformação dos reagentes em produtoDados valores das massas em g . mol -1: 16,0 e S = 32,0c) quais ações podem ser realizadas no sistema, considerando variações de pressão e concentração para aumentar a quantidade de produto formado.
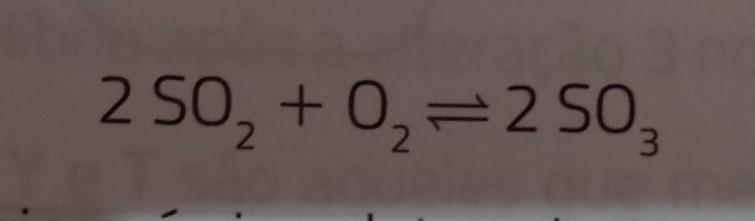
-
Assunto:
Química -
Autor:
dumbledore -
Criado em:
1 ano atrás
Respostas 1
Considerando o sistema gasoso apresentado, utilizando o conceito de equilíbrio químico em uma reação e constante de equilíbrio, encontraremos que: a) Ke = [SO₃]² / ([SO₂]². [O₂]); b) Ke = 3,7; c) Aumentar a pressão.
a) Constante de equilíbrioA constante de equilíbrio é calculada como:
Ke = [produtos] / [reagentes]
Então, considerando a reação balanceada fornecida teremos:
Ke = [SO₃]² / ([SO₂]². [O₂])
b) Valor da Ke
A massa de SO₂ é 50 g então a quantidade inicial em mol é:
N(SO₂) = 50 / 64 = 25/32 mol
N(O₂) = N(SO₂) / 2 = 25/64 mol
No equilíbrio, sabemos que 40 % da quantidade inicial de reagente foi transformada em produto. Então, no equilíbrio temos:
N(SO₂) = 60% . 25/32 = 0,47 mol
N(O₂) = 60% . 25/64 = 0,23 mol
N(SO₃) = 40% . 25/32 = 0,31 mol
Para encontrar as concentrações, basta dividir pelo volume 2 L:
[SO₂] = 0,24 mol/L
[O₂] = 0,12 mol/L
[SO₃] = 0,16 mol/L
Então o valor da Ke é:
Ke = 0,16² / (0,24² . 0,12)
Ke = 3,7
c) Aumentar a quantidade de produto
Em um sistema gasoso, o aumento da pressão favorece a formação das substâncias que ocupam menor volume. Neste caso, são os produtos, pois a proporção é 3 mol de reagente para 2 mol de produto. Então ao aumentar a pressão, favoreceríamos a quantidade de produto formado.
O aumento da quantidade de reagentes também favoreceria a formação de produtos.
Saiba mais sobre equilíbrio químico em: https://brainly.com.br/tarefa/47368517
#SPJ1
-
Autor:
biscuithenderson
-
Avalie uma resposta:
9
