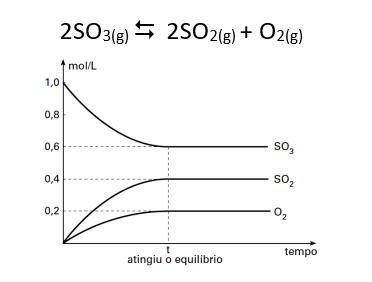
5. Considere o gráfico a seguir, podemos afirmar que, nestas condições, assinale a opção que contém a expressão correta da constante de equilíbrio, KC, e seu valor a)11,25 b) 0,45 c)0,032 d)2 e)0,089

Respostas 1
Aplicando a regra e executando o cálculo do equilíbrio em termos de concentração de reagentes e produtos encontramos o valor de Kc= 0,089. Alternativa e)
Alternativa
Aplicar
[tex]Kc= \dfrac{[Prod]^{x} }{[Reag]^{x} }[/tex] onde
[Prod]= concentração molar dos produtos, [Reag]= concentração molar dos reagentes, x= coeficiente estequiométrico da reação balanceada (havendo mais de 1 reagente/soluto multiplicar todos);
2 SO₃(g) ⇄ 2 SO₂(g) + O₂(g)
Dados do gráfico no equilíbrio
[SO₃]= 0,6 moℓ/ℓ
[SO₂]= 0,4 moℓ/ℓ
[O₂]= 0,2 moℓ/ℓ
[tex]Kc=\dfrac{[SO_{2} ]^{2}\times[O_{2}] }{[SO_{3} ]^{2}}[/tex]
[tex]Kc=\dfrac{0,4^{2} \times0,2 }{0,6^{2} } \\ \\ \\ Kc=\dfrac{0,16\times0,2}{0,36} \\ \\ \\ Kc=\dfrac{0,032}{0,36} \\ \\ \\ Kc=0,089[/tex]
lembre que:
- Kc é a relação entre as concentrações molares dos produtos e dos reagentes e é um nº adimensional;
- só participam da expressão substâncias no estado gasoso e em solução aquosa;
- substâncias sólidas não participam da expressão do Kc
Veja mais em: https://brainly.com.br/tarefa/44792779
https://brainly.com.br/tarefa/53583548
https://brainly.com.br/tarefa/53598269

-
Autor:
dinosaurpknr
-
Avalie uma resposta:
0