Questão problema cálculo de PH (pfvv) 50 pontosForam dissolvidas 20g de NaOH em 100 Litros de solução, Qual o ph da solução preparada? E se prepararmos uma segunda solução pegando 1ml da solução e volumando para 100ml, qual será o ph da solução diluída??
Respostas 1
Após a execução dos cálculos necessários encontramos os seguintes valores:
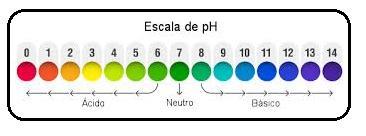
a) primeira solução: pH= 11,7
b) segunda solução: pH= 9,7
Dados
a)
m1= 20 g
V= 100 ℓ
pH= ?
MM(NaOH): 23 + 16 + 1= 40 u ==> MM= 40 g/mol
b)
Vi= 1 mℓ
V= 100 mℓ
pH= ?
a) cálculo da concentração molar da solução
Concentração em quantidade de matéria (ou Concentração em mol/ℓ ou Concentração molar)
Aplicar
[tex]M=\dfrac{m_1}{MM_1\times V}[/tex] onde
M= concentração molar (mol/ℓ)
M₁= massa do soluto (g)
MM₁= massa molar do soluto (g/moℓ)
V= volume da solução (ℓ)
[tex]M= \dfrac{20~g}{40~g/mo\ell\times100~\ell} \\ \\ \\ M= \dfrac{20}{4000} \\ \\ \\ M= 0,005~mo\ell/\ell\\ M=5\times10^{-3} ~mo\ell/\ell[/tex]
- dissociação do NaOH
NaOH(aq) ⇄ Na⁺ + OH⁻
- vemos a dissociação de 1 mol do NaOH gera 1 mol de OH⁻, assim, a concentração de [OH⁻]= 5 x 10⁻³ moℓ/ℓ
- cálculo do pOH
[tex]pOH=-log[OH^{-} ]\\ \\ pOH=-log5\times10^{-3} \\ \\ pOH=3-log5\\ \\ pOH=3-0,7\\ \\ pOH=2,3[/tex]
- como pH - pOH= 14
pH= 14 - 2,3
pH= 11,7
b) cálculo da concentração molar da solução
Aplicar [tex]M1V1=M2V2[/tex]
[tex]M2= \dfrac{5\times10^{-3}~mo\ell/\ell \times1~m\ell}{100~m\ell} \\ \\ \\ M2=0,00005~mo\ell/\ell\\ M2=5\times10^{-5}~mo\ell/\ell[/tex]
- cálculo do pOH
[tex]pOH=-log[OH^{-} ]\\ \\ pOH=-log5\times10^{-5} \\ \\ pOH=5-log5\\ \\ pOH=5-0,7\\ \\ pOH=4,3[/tex]
- como pH - pOH= 14
pH= 14 - 4,3
pH= 9,7
Veja mais em: https://brainly.com.br/tarefa/28696714
https://brainly.com.br/tarefa/33166048
-
Autor:
monkeyenglish
-
Avalie uma resposta:
7