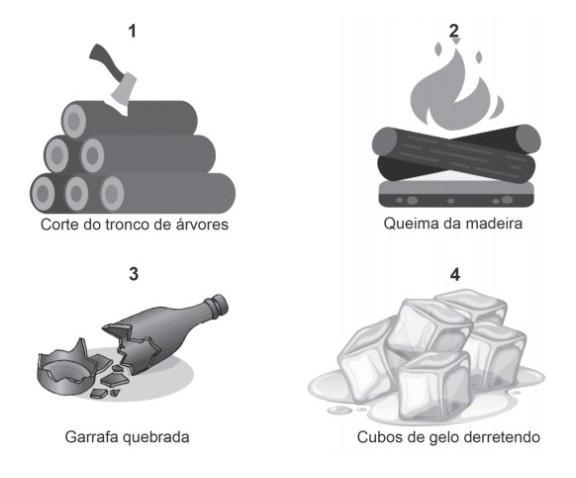
Observe a situação apresentada na imagem abaixo. Qual é a propriedade da matéria apresentada nessa imagem? * Imagem sem legenda A) Cheiro. B) Divisibilidade. C) Elasticidade. D) Textura.

Respostas 2
Resposta:
Letra b) divisibilidade
Explicação:
Espero que tenha ajudado❤
-
Autor:
cannolikjsm
-
Avalie uma resposta:
1
Resposta:
B} divisibilidade.
Explicação:
espero ter ajudado me seque e eu sigo de volta ❤️
-
Autor:
lucianojyb
-
Avalie uma resposta:
2
Você sabe a resposta? Adicione-a aqui!
Escolha um idioma e uma região
How much to ban the user?
1 hour
1 day
100 years