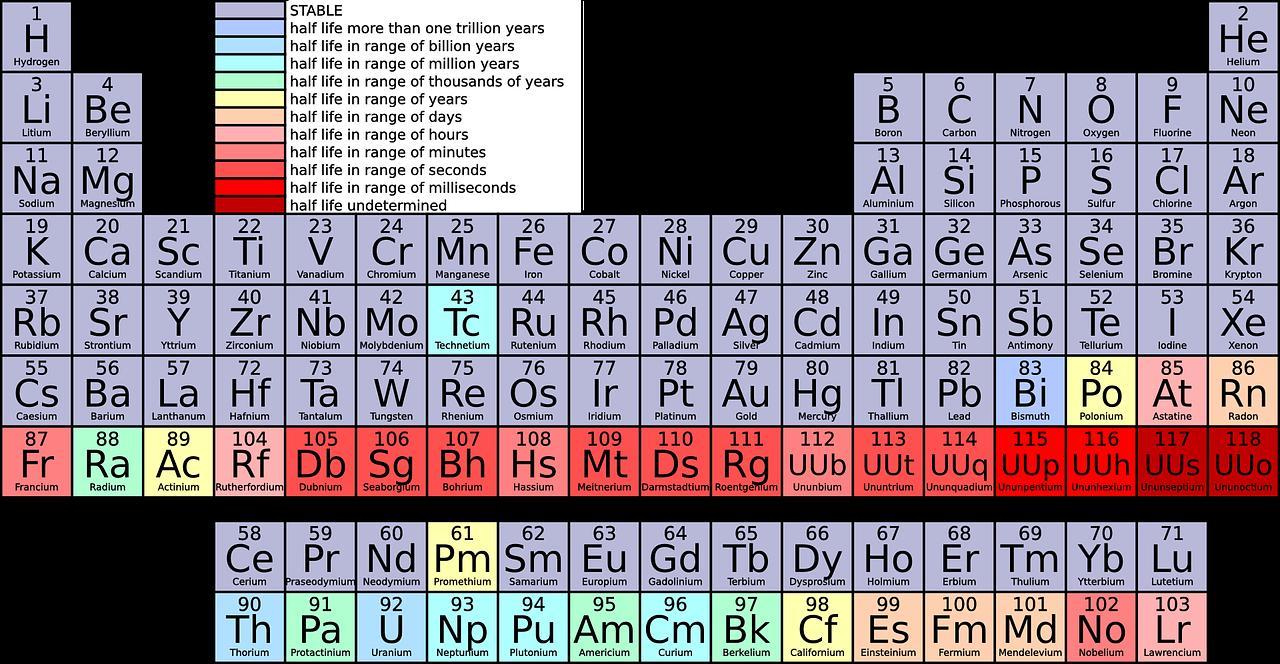
Os gases nobres são os elementos químicos pertencentes ao grupo 18 da Tabela Periódica, isto é, da família do hélio. Todos esses elementos são gasosos em temperatura ambiente (daí o fato de serem chamados de “gases”) e são encontrados na natureza na forma isolada. Isso acontece porque eles são estáveis e possuem pouca reatividade em condições ambientes. É inclusive por isso que eles são chamados de “nobres” ou “raros”. Para que os átomos de enxofre (S) e potássio (K) adquiram configuração eletrônica igual à dos gases nobres, é necessário que: Dados: S (Z = 16); K (Z = 19)
Respostas 2
Resposta:
k perder um elétron
s ganhar dois elétrons
-
Autor:
elenaj8su
-
Avalie uma resposta:
6
Para que o enxofre o potássio atinjam configuração eletrônica igual à dos gases nobres, é necessário observar a família à qual cada um desses elementos pertence na tabela periódica.
Assim, o enxofre deve ganhar elétrons, e o potássio deve doar um elétron.
Enxofre (S): Possui 6 elétrons na camada de valência. Portanto, tende a ganhar 2 elétrons.
Potássio (K): Possui 1 elétron na camada de valência. Assim, tende a doar esse elétron.
Os gases nobres possuem oito elétrons na camada de valência, com a exceção do Hélio (He), que antige a estabilidade com apenas 2.
Aprenda mais em: https://brainly.com.br/tarefa/27692386
-
Autor:
ramírezxzs0
-
Avalie uma resposta:
4
Você sabe a resposta? Adicione-a aqui!
Escolha um idioma e uma região
How much to ban the user?
1 hour
1 day
100 years